1. Definizione
La Medicina Basata sull’Evidenza (MBE) può essere definita come una pratica clinica fondata su conoscenze scientifiche aggiornate e metodologicamente valide (le cosiddette “evidenze”). Infatti ancora oggi, sia pure in misura minore rispetto al passato, molti aspetti della Medicina scaturiscono da esperienze certamente importanti ma non sistematizzate né strutturate secondo una rigorosa metodologia scientifica.
Il tema della MBE iniziò a maturare negli anni ’80 ma si impose definitivamente all’attenzione generale nei primi anni ’90 con la costituzione anche formale di due gruppi di ricerca. Il primo si raccolse a Oxford nella Cochrane Collaboration, l’associazione che si riprometteva di proseguire ed estendere il lavoro dell’epidemiologo Archibald Leman Cochrane. Il secondo gruppo di ricerca faceva capo al Dipartimento di Epidemiologia Clinica e Biostatistica della McMaster University di Toronto (Canada). Ad esso si deve la pubblicazione nei primi anni ’90 di una serie di articoli sulla valutazione critica degli interventi in sanità comparsi su una rivista americana, JAMA1.
E proprio in questi articoli risiedeva la vera novità rispetto ad altri approcci che pure facevano riferimento ai risultati della ricerca scientifica. Infatti, i ricercatori della McMaster University andarono oltre la definizione per entrare nel metodo con il quale individuare, stratificare ed, in ultima analisi, quantificare l’evidenza. Essi infatti proposero, sin dagli albori del dibattito, i criteri fondamentali per stabilire il livello di evidenza clinica delle prove scientifiche2, criteri che rispondevano all’obiettivo di misurare la validità metodologica dello studio facendo ricorso agli strumenti dell’epidemiologia e della statistica.
Infatti, a differenza di quanto accade nello studio dei fenomeni deterministici, la valutazione dei fenomeni collettivi, ovvero che variano nelle loro manifestazioni individuali, deve tener conto di due possibili tipi di errore: accidentale e sistematico3. La stratificazione delle evidenze è basata sull’assunzione che la validità di un risultato scientifico dipende dalla sua accuratezza, che può essere inficiata dagli errori sistematici ma che può essere garantita da un disegno sperimentale adeguato, e dalla sua precisione, che è minacciata dagli errori accidentali ma può essere opportunamente valutata con l’uso di procedure statistiche corrette. La minimizzazione dell’errore d’altronde non garantisce certezza ma si traduce in risposte di tipo probabilistico4,5.
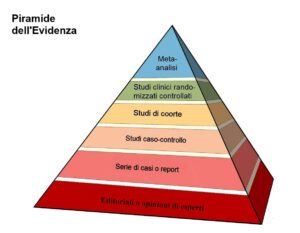
Sulla base di questi principi, il gruppo della McMaster University individuò cinque livelli che costituivano una scala ordinale decrescente nella quale l’evidenza diviene progressivamente meno forte man mano che la validità dello studio si indebolisce sotto il profilo epidemiologico e statistico. Successivamente gli stessi ricercatori della McMaster University, ma anche altri gruppi, ritennero di aggiornare e modificare questa stratificazione dell’evidenza. Nella figura 1 è riportata una classificazione delle evidenze abbastanza fedele all’originale. In tutte le versioni adottate rimane, comunque, una gerarchizzazione delle evidenze fondata sulla forza dell’inferenza e questa continua ad essere misurata sulla base dell’accuratezza epidemiologica e della precisione statistica.
Forse ora si comprende meglio una delle definizioni che fu data della MBE, intesa come “uso consapevole, esplicito e responsabile delle migliori prove scientifiche disponibili allo scopo di assumere decisioni nella pratica medica”6. La MBE fu inizialmente definita come “un nuovo paradigma emergente per la pratica medica”7. Tuttavia, nonostante i rischi contenuti in questa impostazione iniziale tendenzialmente “integralistica”, essa non si è sviluppata come ideologia totalizzante. E d’altronde sarebbe ormai impresa assai ardua voler organizzare in dogma l’enorme produzione scientifica sull’argomento considerando che attualmente nella banca data PubMed sono censite oltre 68.018 pubblicazioni che fanno espresso riferimento alla Medicina Basata sull’Evidenza8. Proprio perché la MBE non si configura in dogma, di essa non esiste né può esistere una lettura “ortodossa”. E per questa ragione si è ritenuto chiarire già in via preliminare una delle sue possibili interpretazioni.
2. Aspettative e credibilità della Medicina
Si è detto che la Medicina Basata sull’Evidenza si riproponeva di ristrutturare la conoscenza medica sulla base dei risultati della ricerca scientifica. Anche allo scopo di rispondere alla crisi di credibilità generale del sistema di tutela della salute, inteso nella sua interezza ovvero sia sotto il profilo meramente assistenziale che dal punto di vista strettamente culturale.
La “semeiotica” di questa crisi presenta fondamentalmente due modalità di espressione che finiscono per alimentarsi reciprocamente. Innanzitutto il divario tra le aspettative dell’opinione pubblica ed i risultati che la Medicina riesce concretamente ad ottenere. In secondo luogo è operante l’incongruenza tra uno sviluppo prorompente delle metodiche diagnostiche ed un progresso in ambito terapeutico non altrettanto rilevante.
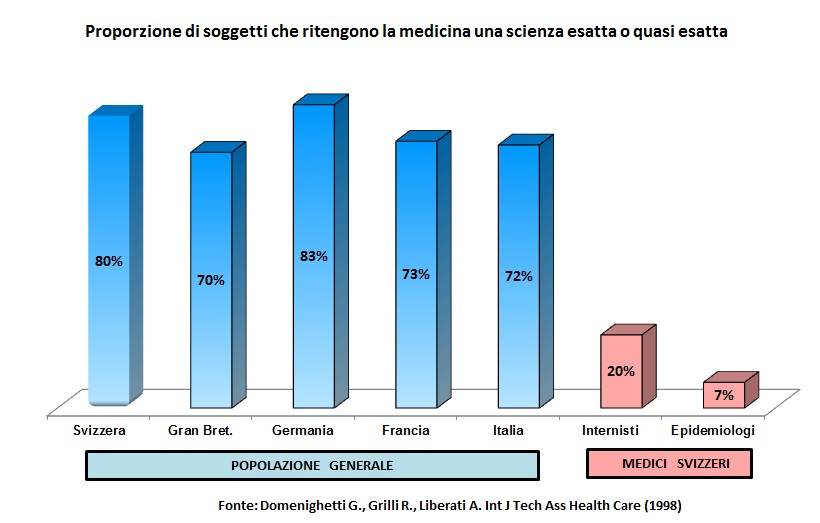
Si è detto che un aspetto importante della crisi è rappresentato dalla eccessiva fiducia riposta dall’opinione pubblica nella Medicina. Basti pensare ai risultati di un sondaggio condotto negli anni ’90 da un gruppo di ricerca guidato dallo studioso svizzero Gianfranco Domenighetti, docente di Economia e Politica Sanitaria presso le Università di Losanna e Ginevra. In quella circostanza, alla domanda “La Medicina è una Scienza esatta?”, una percentuale variabile tra il 70% e lo 83% dell’opinione pubblica rispondeva affermativamente (figura 2). Nella classe medica svizzera tale percentuale si riduceva ma si attestava comunque su percentuali ragguardevoli9. Questa incredibile “fiducia” riposta nella Medicina è una delle ragioni che alimentano la delusione e talora l’ostilità della opinione pubblica nei confronti del sistema sanitario quando esso non riesce a soddisfare aspettative più o meno legittime ma spesso sovradimensionate. Sarebbe molto interessante ripetere oggi l’indagine. C’è da augurarsi che la percentuale di medici si sia ridotta a zero. Invece, vista la mitologia imperante nella rete, c’è da temere che sia in crescita la quota di opinione pubblica che pretende una scienza esatta.
Un’altra faccia della crisi di credibilità della Medicina è rappresentato dalla distanza che ormai si è creata tra l’aumentata capacità diagnostica di metodiche sempre più sofisticate ed una crescita non altrettanto rilevante dell’efficacia terapeutica. In linea generale si può convenire sul fatto che nel corso del tempo si sia passati da una condizione di sostanziale sovrapposizione, quantunque realizzata ad un livello minimo, tra possibilità diagnostiche e terapeutiche ad una situazione di forte e crescente divaricazione. D’altronde, anche quando l’avvento di tecniche più avanzate determina nuovi atteggiamenti terapeutici, la loro efficacia può risultare sovrastimata per l’intervento di una duplice distorsione legata alla maggiore precocità della diagnosi e al fatto che tanto più lunga è la fase preclinica della malattia tanto maggiore sarà la probabilità di una diagnosi anticipata. Ulteriore elemento che sostiene una visione distorta dell’utilità degli esami diagnostici è rappresentato dalla confusione che si ingenera tra precisione tecnica dello strumento ed il suo impatto in termini di diagnosi. Così l’elevata precisione fisica della Risonanza Magnetica Nucleare non garantisce un altrettanto elevata precisione diagnostica che dipende da molti altri fattori come la variabilità biologica e l’imperfetta conoscenza di come un processo patologico si traduce in immagine. Ancora oggi c’è bisogno di verificare con indagini metodologicamente corrette l’impatto della RMN in termini di modificazione delle scelte terapeutiche e miglioramento dello stato di salute dei pazienti.
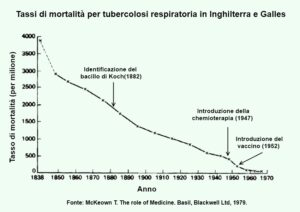
Così appare particolarmente stridente il contrasto tra una visione “mitica” della Medicina e l’influenza che essa realmente esercita sulla salute delle persone. Thomas McKeown, già nel 1979, sosteneva che la clamorosa riduzione del tasso di mortalità per tubercolosi in Inghilterra e Galles fu poco o nulla influenzata da quelle che ancora oggi sono considerate le grandi scoperte della Medicina nel campo10. Così la identificazione del bacillo di Koch (1882), l’introduzione della chemioterapia con streptomicina (1947) e persino l’avvento di un vaccino specifico (1952) non modificarono sostanzialmente il ritmo di declino della mortalità per tubercolosi, evidentemente attribuibile ad altri fattori ed in particolare al miglioramento delle condizioni di salute generale e di vita della popolazione (figura 3). La tesi di McKeown fu criticata da diversi punti di vista, a cominciare dalla possibile confusione delle cause di morte in anni lontani nel corso dei quali le diagnosi non erano certo molto accurate. Ne scaturì una storica controversia che per molti aspetti perdura ancora a riprova di quanto fosse salutare aprire una discussione sulla reale efficacia degli interventi sanitari.
3. Le cause profonde di una crisi
Se la “semeiotica” della crisi della Medicina è ormai definita, la sua “eziologia” deve ancora essere compiutamente individuata. Sotto questo profilo si può sostenere che la Medicina moderna contiene, irrisolte, almeno due questioni generali di rilevanza decisiva.
La prima è inerente la natura del diritto alla salute, sulla cui interpretazione si ripropone in qualche modo l’eterno conflitto giusnaturalismo-positivismo, la cui soluzione è evidentemente decisiva nella scelta di un sistema di razionalizzazione-razionamento dell’assistenza sanitaria. Il diritto alla salute può essere inteso come diritto naturale che, in quanto tale, è assoluto ed immutabile oppure come diritto positivo, il cui contenuto si rinnova in rapporto alle contingenze storiche, culturali ed economiche. Gli echi di questo contrasto, sia pure analizzato su un piano meramente pragmatico e non certo filosofico, sono presenti da lungo tempo nella letteratura medica anglosassone11-14..
In secondo luogo la Medicina risente della questione epistemologica ovvero del contrasto di fondo tra due teorie della conoscenza che partono da presupposti diversi (relativi alla certezza della verità scientifica), utilizzano una metodologia diversa (conferma o falsificazione delle ipotesi) e giungono naturalmente a conclusioni diverse sulla natura della conoscenza (somma di informazioni o correzione degli errori)15. La questione non è un fatto solo teorico perché le due diverse impostazioni possono avere implicazioni concrete di grande rilevanza in ognuna delle tappe che dall’osservazione del caso clinico portano alla diagnosi e all’offerta terapeutica.
L’impostazione metodologica proposta dalla MBE, in particolare la stratificazione delle evidenze e l’interpretazione probabilistica dei risultati scientifici, in qualche modo supera e ricompone i conflitti culturali cui si è accennato, sia quello tra giusnaturalismo e positivismo che quello insito nella questione epistemologica, offrendo alla Medicina gli strumenti operativi per uscire dalla paralisi culturale e per continuare a svolgere la sua funzione pratica che è quella di produrre salute. In particolare, alla luce di quanto esposto in precedenza, diviene meno drammatico, su un piano strettamente operativo, l’interrogativo sulla certezza o meno della verità scientifica quando gli strumenti teorici di cui si dispone consentono di ragionare solo in termini di probabilità.
4. Le Ragioni di una medicina basata sull’evidenza
Quanto riassunto in precedenza introduce l’argomento più ampio che riguarda l’insieme delle ragioni che rende non più rinviabile un rinnovamento profondo della pratica medica sulla base di un’impostazione metodologica rigorosa. Questa necessità deriva da una molteplicità di ragioni di ordine pratico, economico ed etico e che alla fin fine possono essere riassunte nell’esigenza fondante della Medicina di ottenere informazioni corrette da offrire al paziente e da attuare nella pratica clinica.
4a. Identificare e discriminare l’informazione corrente ai fini della pratica clinica
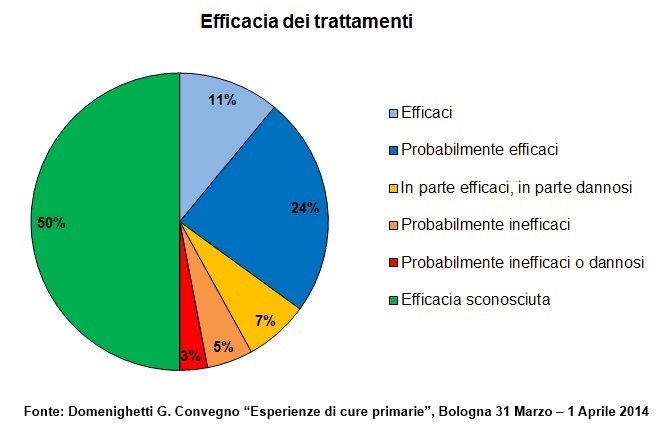
Quello delle fonti della conoscenza è un problema storico, e per molti versi ancora irrisolto, della Medicina. Sono noti casi anche clamorosi di informazioni sicuramente erronee o quantomeno non fondate su alcuna solida ragione scientifica che sono rimaste a lungo nella pratica clinica o che si sono diffuse al punto di rischiare di entrare pratica clinica. Secondo R. Smith, già direttore del British Medical Journal, si poteva calcolare che nei primi anni ’90 solo il 15% delle terapie praticate erano fondate su solide prove scientifiche16. Nel corso del tempo la situazione è migliorata ma non tanto quanto ci si potrebbe aspettare. Nel 2012 su 3.000 trattamenti oggetto di trial clinici randomizzati controllati, solo lo 11% potevano essere considerati efficaci, il 24% probabilmente efficaci, il 7% in parte efficaci e in parte dannosi, il 5% come probabilmente inefficaci, il 3% come probabilmente inefficaci o dannosi e ben il 50% di efficacia sconosciuta17 (figura 4).
Sono altresì noti casi nei quali un’informazione corretta ha impiegato tempi clamorosamente lunghi per affermarsi. E’ nota la vicenda della terapia dello scorbuto, una malattia molto grave di cui soffrivano i marinai nel corso del lungo tempo che trascorrevano in mare18. Dal 1601, quando James Lancaster osservò per la prima volta che il succo di limone poteva prevenire la malattia, si dovette aspettare circa un secolo e mezzo perché James Lind, nel 1747, ripetesse l’esperimento. Ancora altro tempo fu necessario affinché l’osservazione sperimentale divenisse pratica clinica: la marina militare e quella mercantile della Gran Bretagna iniziarono a portare limoni sulle navi per prevenire e curare lo scorbuto, rispettivamente, nel 1795e nel 1865. Occorsero dunque ben due secoli e mezzo prima che un’osservazione decisiva trovasse un’applicazione concreta che consisteva peraltro in un misura molto semplice quale era quella di imbarcare agrumi (figura 5).

Si potrebbe pensare che oggi ci si trova in un contesto opposto nel quale l’ampia informatizzazione condizioni una crescente circolazione delle conoscenze scientifiche e faciliti il passaggio delle informazioni dalla ricerca alla pratica clinica. Eppure non è esattamente così. Innanzitutto l’informazione può trasmettersi in maniera distorta ed in proposito basti ricordare tutto il trambusto inconsulto sulla utilità delle vaccinazioni. In secondo luogo, proprio la pletora di informazione scientifica e la sua disseminazione a pioggia possono determinare una situazione opposta a quella vista nel caso dello scorbuto ma dal risultato assolutamente convergente: l’informazione corretta può essere sommersa dal grande mare di notizie inutili, fuorvianti ed erronee. Ancora oggi, infatti, i tempi con i quali un’evidenza scientifica viene accolta da tutti sul piano culturale possono essere molto lunghi. Così, in un passato recente, trascorsero circa tredici anni dalla dimostrazione dell’efficacia della trombolisi nell’infarto del miocardio prima che questa terapia divenisse raccomandata19.
La MBE può diventare un utile strumento per guidare i medici nel mare magnum dell’informazione scientifica. Nella sua ispirazione originaria, la Medicina basata sull’evidenza aveva come referente privilegiato proprio la pratica clinica20. In particolare si riproponeva di sostenere i medici nella decisione clinica offrendo loro un metodo scientificamente fondato. Allo scopo furono pubblicati su JAMA, a partire dai primi anni ’90, una serie di articoli nei quali si descrivevano gli strumenti teorici per valutare criticamente la letteratura scientifica sotto i diversi profili utili alle esigenze cliniche21.
4b. Implementare i risultati della ricerca scientifica in una politica clinica
Si è visto che i tempi di latenza con i quali un’evidenza scientifica viene accolta da tutti sul piano culturale possono essere molto lunghi. Ancora più lunghi sono in genere i tempi di implementazione dell’evidenza scientifica in una politica clinica.
Da molti anni ormai è dimostrato che nelle emorragie digestive da ulcera peptica, l’unico intervento che con certezza riduce mortalità, interventi chirurgici e recidive è rappresentato dalla sclerosi endoscopica d’urgenza22. Tutti i farmaci che vengono somministrati endovena, compresi i potenti e costosi inibitori della pompa protonica, non hanno nessun effetto e le emorragie digestive che si arrestano nel corso di un trattamento farmacologico (fortunatamente nella maggior parte dei casi) lo fanno per autolimitazione.
L’efficacia della sclerosi endoscopica, già evidenziata nei singoli trials, fu poi ribadita in due meta-analisi23,24 ed accolta definitivamente nel consesso scientifico nel 199325. Da allora tale evidenza non è stata più messa in discussione tanto che successivamente, per ragioni etiche, non è stato intrapreso nessun altro studio randomizzato controllato. Eppure a tutt’oggi, nella pratica, non tutti i pazienti con emorragia digestiva acuta da ulcera peptica sono sottoposti ad endoscopia d’urgenza.
4c. Codificare la pratica clinica
La pratica clinica consiste nel dare risposte semplici a problemi complessi. Questo comporta la necessità di codificare i comportamenti secondo criteri precisi e non ambigui26.
Raccomandazioni cliniche appaiono come semplici affermazioni nel contesto di un libro o di un articolo oppure sono espresse come indicazioni, controindicazioni, farmaci di scelta, elementi essenziali per la diagnosi, ecc. Talora esse sono contenute nei documenti prodotti dalle varie organizzazioni culturali o politiche che si occupano di sanità. La multiformità con la quale tali norme vengono espresse rende più difficile la loro attuazione27. Da qui la necessità di stabilire criteri generali basati su regole omogenee ed universalmente accettate per implementare nella pratica clinica i risultati della ricerca scientifica.
4d. Informare correttamente il paziente
Informare correttamente il paziente non significa porlo di fronte ad un elenco di tutti i possibili esiti che possono derivare dall’intervento proposto. Significa invece sottoporre al suo giudizio le probabilità degli eventi favorevoli e di quelli sfavorevoli. Questa operazione richiede che il medico proceda ad un’analisi accurata della letteratura e, se possibile, alla razionalizzazione della propria esperienza con metodo concettualmente statistico. Così, se un chirurgo ritiene di dover proporre un intervento, è corretto, al di là delle implicazioni medico-legali poste dal consenso informato, che egli accompagni la proposta con una valutazione rischio-beneficio tratta dalla letteratura ma anche relativa al proprio rendimento.
In linea generale, di fronte all’offerta generica, il paziente si dispone a massimizzare i benefici e a minimizzare il “rammarico” di un’occasione persa, presumibilmente in relazione ad una visione eccessivamente ottimistica delle possibilità della Medicina. Così il 60% dei pazienti, di fronte ad un’informazione generica, ritenne di aderire ad un programma di screening del cancro del pancreas sottoponendosi ad un test semplice come il dosaggio ematico del Ca 19.9. Il grado di adesione scendeva al 13.5% quando i pazienti venivano informati della dubbia utilità del test (70% di falsi positivi), del fatto che la sua positività avrebbe comportato ulteriori indagini per confermare la diagnosi, della estrema rarità del tumore indagato (incidenza pari a 11 casi ogni 100.000 individui), della sua prognosi comunque infausta (sopravvivenza a cinque anni pari al 3%)28.
4e. Integrare l’esperienza individuale
Spesso si tende ad adottare dei comportamenti sulla base della propria esperienza la cui importanza, niente affatto trascurabile, va comunque ricondotta nei suoi termini reali. Se la valutazione soggettiva conserva ancora un ruolo insostituibile in ambito diagnostico, in quanto componente essenziale dell’intuizione29 e elemento fondamentale per la quantificazione della probabilità a priori30, la sua pretesa “inferenziale” in ambito terapeutico è fortemente discutibile. In altri termini la critica all’esperienza riguarda la possibilità che, a partire dai singoli pazienti trattati personalmente, il medico possa procedere a generalizzare un comportamento terapeutico sui casi futuri che si troverà a gestire. Una rassegna recente suggerisce che l’esperienza, misurata in anni di attività, comporta una minore “performance” del medico in termini di aderenza alle linee guida e di adozione di procedure più appropriate ma anche in termini di esiti clinici riscontrati sui pazienti31.
Diverse sono i meccanismi di pregiudizio ed errore che possono corrompere la validità dell’esperienza individuale32:In genere si tende a ricordare, e quindi a sopravvalutare, i risultati positivi dei trattamenti prescritti mentre si è portati naturalmente a rimuovere, e quindi a sottostimare, quelli negativi.
- La valutazione soggettiva risente inevitabilmente del grado di adesione dei pazienti al trattamento stabilito. I pazienti che accetteranno le prescrizioni finiranno per costituire la parte preponderante dell’esperienza individuale del medico. Essi presenteranno una prognosi migliore, anche in termini di sopravvivenza, rispetto ai pazienti che avranno rifiutato il trattamento. Questo può portare il clinico a sopravvalutare l’efficacia dell’intervento prescritto.
- Nella pratica clinica, il medico ed il paziente non operano in in cieco. Di conseguenza sia l’effetto placebo che il desiderio di entrambi di pervenire al successo terapeutico conducono ad una sovrastima dell’efficacia e/o ad una sottostima delle complicanze dell’intervento praticato.
- Il medico difficilmente si trova nella condizione di poter elaborare autonomamente la propria esperienza in modo da comprendere quella che viene definita la “tendenza alla normalità” di molti fenomeni naturali. Il problema fondamentale è, in questo caso, che la tendenza alla normalità si estrinseca pienamente solo dopo un numero sufficiente di osservazioni, la cui grandezza non può essere prevista dal singolo professionista.
- Un altro aspetto limitante dell’esperienza individuale è il fatto che le conseguenze di un intervento non sono sempre facilmente intellegibili. Così non è affatto semplice stabilire, solo sulla base delle proprie osservazioni, se esiste una relazione tra l’uso di un certo antiipertensivo e la mortalità nell’ictus ischemico, una malattia che di per sé condiziona complicanze fatali in una percentuale elevata di casi. Per le stesse ragioni è difficile stabilire, solo sulla base della propria capacità di analisi, quanti pazienti portatori di ictus ischemico in fase acuta siano clinicamente peggiorati perché messi bruscamente in posizione seduta. Invece, l’uso di questo o quel farmaco antiipertensivo ed il tipo di mobilizzazione del paziente in fase acuta sono considerati problemi di assoluta rilevanza clinica nella gestione dei pazienti con ictus cerebrale.
Dunque, l’esperienza per essere proficua deve essere integrata con l’acquisizione costante di quelle conoscenze scientifiche che consentono di superare i limiti della realtà individuale. E’ chiaro che non bisogna nemmeno esagerare perché talora l’esperienza ed il buon senso sono esaustivi. Così è noto che l’uso del paracadute riduce grandemente il rischio di trauma dovuto alla caduta da grandi altezze sebbene la sua efficacia non sia stata documentata in nessun trial clinico randomizzato controllato (figura 6)33. E semmai qualcuno volesse intraprendere questo studio difficilmente troverebbe persone disposte a sperimentare la caduta senza paracadute. Tutti invece sceglierebbero di fare il controllo, quello che indossa il paracadute.

4f. Orientare equamente le risorse
Un altro punto che rende irrinunciabile una medicina basata sull’evidenza clinica è costituito dalla assoluta necessità di orientare selettivamente ed equamente le risorse finanziarie. E qui il problema economico si intreccia con quello etico.
In tutto l’Occidente, la spesa sanitaria totale cresce ad un ritmo sempre maggiore erodendo quote progressivamente più ampie di prodotto interno lordo (figura 7). Da sottolineare che cresce indefinitamente anche la spesa sanitaria pubblica persino in quei Paesi, come gli Stati Uniti, dove l’assistenza medica è prevalentemente privata34,35. E questo accadeva già prima della riforma sanitaria voluta da Obama. Una delle principali fonti di spesa è rappresentata da una prescrizione medica (di terapie e di indagini diagnostiche) particolarmente dispendiosa, affatto informata ai criteri dell’evidenza clinica, sensibile agli stimoli più diversi e che finisce per comprendere una parte rilevante di trattamenti che non hanno sicura dimostrazione scientifica36. Nel 2012 si è calcolato che negli USA il 30% della spesa sanitaria è stata utilizzata per interventi che non portavamono alcun beneficio37.
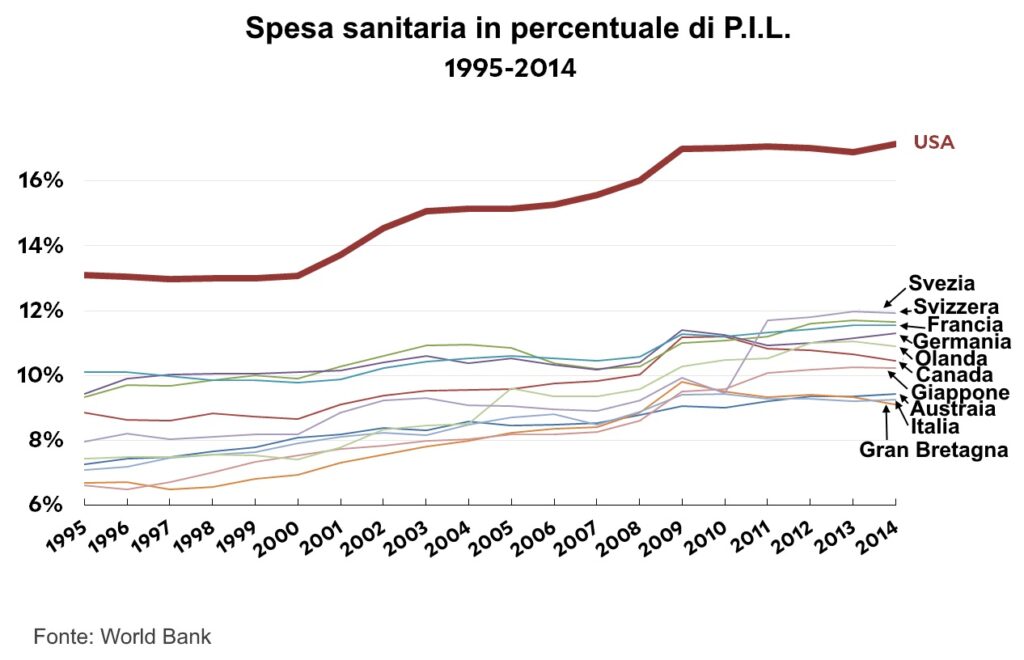
Essendo le risorse economiche per definizione limitate, si sta correndo il rischio che in breve tempo non si potrà più far fronte a larga parte della esigenze di salute delle popolazioni. E’ questo un nodo centrale della Medicina di oggi che nei Paesi di cultura anglosassone, per ragioni economiche ma anche etiche, vanno risolvendo nel senso di erogare solo le terapie la cui efficacia sia scientificamente dimostrata38. Questa strategia consente di erogare un maggior numero di terapie efficaci ad un maggior numero di pazienti39. Anzi, secondo un’autorevole scuola di pensiero, sarebbe addirittura possibile somministrare a tutti, e gratuitamente, tutti i trattamenti sicuramente efficaci, al prezzo di negare terapie la cui efficacia non è dimostrata40. Naturalmente occorre compiere la scelta del livello di evidenza al di sotto del quale l’efficacia di un trattamento non è considerata dimostrata. La scelta è di carattere politico e comporta forti implicazioni etiche.
La scelta del livello di evidenza minimo non esaurisce il problema etico che presenta altri e più complessi aspetti, primo tra tutti la necessità di orientare le limitate risorse economiche sugli interventi che producono i risultati maggiori. Sotto il profilo della politica sanitaria infatti è necessario valutare non solo l’efficacia di un trattamento ma anche l’ampiezza del beneficio prodotto.
L’entità del risultato si misura in vari modi. Uno è lo NNT (number needed to treat) ovvero il numero di pazienti che occorre trattare per evitare un evento sfavorevole (in genere morte e disabilità). Lecito quindi chiedersi se la limitatezza delle risorse imponga di finanziare gli interventi con un’ampiezza di beneficio maggiore.
I diversi aspetti della questione etica riconoscono diversi ambiti di competenza, alcuni dei quali strettamente politici E’ nell’elaborazione di una strategia sanitaria centralizzata che vanno individuati gli interventi sui quali concentrare le risorse disponibili sulla base dell’evidenza e dell’ampiezza del risultato da raggiungere. E’ in questa sede che va deciso se un intervento, sicuramente efficace sulla base del massimo livello di evidenza ma che produce un piccolo beneficio debba essere accantonato a favore magari di un altro intervento, ugualmente evidente e costoso, ma che riesce a cogliere un risultato più ampio.
CDL, 16 novembre 2006, ultima revisione ottobre 2018, pubblicato il 29 aprile 2019
- Centre for Halth Evidence. Users’ Guides to Evidence-Based Practice.
- Cook DJ, Guyatt GH, Laupacis A, Sackett DL. Rules of evidence and clinical recommendations on the use of antithrombotic agents. Chest 1992; 102(suppl 4): 305S-311S.
- Ballatori E. Statistica come metodologia del processo di acquisizione di conoscenze scientifiche. In: Statistica e Metodologia della Ricerca, pp 13-31. Margiacchi-Galeno, Città di Castello (PG), 1996.
- Ballatori E. Primo anno del Corso di lezioni di Statistica. Scuola di Specializzazione di Statistica Sanitaria. Università degli Studi dell’Aquila. Anno accademico 2003-2004.
- Ballatori E. Statistica come metodologia del processo di acquisizione di conoscenze scientifiche. In: Statistica e Metodologia della Ricerca, pp 13-31. Margiacchi-Galeno, Città di Castello (PG), 1996.
- Sackett DL, Rosenberg WC, Gray JAM, Haynes RB, Richardson WS. Evidence Based Medicine. What it is and what it isn’t. BMJ 1996; 312: 71-72.
- Evidence-Based Working Group. Evidence-based Medicine: A new approach to teaching the practice of medicine. JAMA 1992; 268: 2420-2425.
- Ricerca bibliografica eseguita in data 17/05/2018 con “Evidence-Based Medicine” come parole chiave.
- Domenighetti G., Grilli R., Liberati A. Promoting Consumers’ Demand for Evidence-Based Medicine. Int. J. Tech. Ass. Health Care, 14:97-105, 1998.
- McKeown T. The role of Medicine, Basil, Blackwell Ltd, 1979.
- Eddy DM. Clinical decision making: from theory to practice. Principles for making difficult decisions in difficult times. JAMA 1994; 271: 1792-1798.
- Eddy DM. Rationing resources while improving quality. JAMA 1994; 272: 817-824.
- Council on Ethical and Judicial Affaire, American Medical Association. Ethical issues in health care system reform. JAMA 1994; 272: 1056-1062.
- Eddy DM. Health system reform. Will controlling costs require rationing services? JAMA 1994; 272: 324-328.
- McIntyre N, Popper K. The critical attitude in medicine: the need for a new ethics. BMJ 1983; 287: 1919-23.
- Smith R. The ethics of ignorance. J. Med. Ethics 1992; 18: 117.
- Informazione tratta da: Gianfranco Domenighetti. Per una politica sanitaria anche di tipo culturale. Convegno “Esperienze di cure primarie”, Bologna 31 Marzo – 1 Aprile 2014. Austin Frakt. Half of medical treatments of unknown effectiveness. The Incidental Economist. The health services research blog. January 16, 2013.
- Haines A, Jones R. Implementing findings of research. BMJ 1994; 308: 488-492.
- Antman E, Lau J, Kupelnick B, Mosteller F, Chalmers I (1992). A comparison of the results of metaanalysis of randomised controlled trials and recommendations of clinical experts. JAMA, 268: 240-8.
- La medicina basata sull’evidenza. Bollettino d’informazione sui farmaci 2003; 10: 127-137.
- Centre for Halth Evidence. Users’ Guides to Evidence-Based Practice.
- Chalmers TC, Lau J. Randomized control trials and meta-analyses in gastroenterology: major achievements and future potentials. In: Doing More Good than Harm. The Evaluation of Health Care Interventions. pp 96-106, Warren KS and Mosteller F, eds. The New York Academy of Sciences, New York, 1993.
- Sacks HS, Chalmers TC, Blum AL, Berrier J, Pagano D. Endoscopic hemostasis. An effective therapy for bleeding peptic ulcers. JAMA 1990; 264: 494-499.
- Cook DJ, Guyatt GH, Salena BJ, Laine LA. Endoscopic therapy for acute non variceal upper gastrointestinal hemorrhage: a meta-analysis. Gastroenterology 1992; 102: 139-148.
- Chalmers TC, Lau J. Randomized control trials and meta-analyses in gastroenterology: major achievements and future potential. Doing More Good Than Harm: The Evaluation of Health Care Interventions. Conference proceedings. New York, Ann NY Acad Sci 1993 703: 96-105.
- Eddy DM. Clinical policies and quality of clinical practice. New Engl. J. Med 1982; 307: 343-347.
- Eddy DM. Clinical policies and quality of clinical practice. New Engl. J. Med 1982; 307: 343-347.
- Domenighetti G. Does provision of an evidence-based information change public willingness to accept a screening test? January 1999, Cahier no 9901.
- Evidence-Based Working Group. Evidence-based Medicine: A new approach to teaching the practice of medicine. JAMA 1992; 268: 2420-2425.
- Ballatori E. Primo anno del Corso di lezioni di Statistica. Scuola di Specializzazione di Statistica Sanitaria. Università degli Studi dell’Aquila. Anno accademico 2003-2004.
- Choudhry NK, Fletcher RH, Soumerai SB. Systematic review: the relationship between clinical experience and qualità of health care. Ann. Intern. Med. 2005; 142: 260-273.
- Cook DJ, Guyatt GH, Laupacis A, Sackett DL. Rules of evidence and clinical recommendations on the use of antithrombotic agents. Chest 1992; 102(suppl 4): 305S-311S.
- Smith GCS, Pell JP. Parachute use to prevent death and major trauma related to gravitational challenge: systematic review of randomised controlled trials. BMJ 327: 1459-1461, 2003.
- Eddy DM. Clinical decision making: from theory to practice. Principles for making difficult decisions in difficult times. JAMA 1994; 271: 1792-1798.
- OECD (2014). OECD Stat extracts 2014.
- Eddy DM. Clinical decision making: from theory to practice. Principles for making difficult decisions in difficult times. JAMA 1994; 271: 1792-1798.
- Berwick D.M., Hackbarth A.D. Eliminating waste in US health care. JAMA, 307:1513-1516, 2012.
- Eddy DM. Rationing resources while improving quality. JAMA 1994; 272: 817-824.
- Eddy DM. Clinical decision making: from theory to practice. Principles for making difficult decisions in difficult times. JAMA 1994; 271: 1792-1798.
- Warren KS. All effective treatment could be free. In: Doing More Good than Harm. The Evaluation of Health Care Interventions. pp 1-4, Warren KS and Mosteller F, eds. The New York Academy of Sciences, New York, 1993.